BIOLOGIA |
El ion calcio: un lenguaje celular |
|
© Cristina Camello, Pedro Camello , 2000
pcamello@unex.es, Departamento de Fisiología de la . Universidad de Extremadura (España) |
RESUMEN [ABSTRACT]
El ion calcio es un mensajero intracelular utilizado por numerosas hormonas y neurotransmisores para activar múltiples funciones celulares, desde la contracción o la secreción hasta la expresión de genes. Sus implicaciones fisiológicas son por tanto diversas, desde su papel en tejidos secretores o el músculo hasta la transmisión sináptica. El desarrollo de este campo se ha acelerado mucho durante la década de los ochenta y noventa, con la caracterización de los sistemas de transporte de calcio que dan forma a las señales producidas por hormonas y neurotransmisores. Actualmente es evidente que las señales de calcio son un código heterogéneo que se adapta a las funciones de cada tipo celular. Este código puede considerarse como un idioma o lenguaje celular, cuyos componentes comienzan ahora a desvelarse.
De perros, mensajes y palomas
Una tarde de principios de siglo unos fisiólogos británicos realizaban un experimento: al instilar ácido en el duodeno de un perro el páncreas secretaba un copioso volumen de jugo pancreático (Bayliss y Starling, 1902). Como la secreción pancreática también aumentaba al inyectar intravenosamente un extracto de intestino delgado o sangre de otro perro en periodo de digestión, era obvio que el quimo procedente del estómago liberaba desde el intestino hacia la circulación general "algo" que ordenaba al páncreas hacer su trabajo (verter en el duodeno una secreción rica en enzimas digestivas y bicarbonato). Había nacido el concepto de "hormona" (literalmente "poner en movimiento"), aunque ese nombre no se utilizó hasta un corto tiempo después.
Comprender por qué el páncreas hace su trabajo cuándo y cómo debe hacerlo es algo que, además de ser una tarea inacabada que ha ocupado a fisiólogos y otros investigadores durante buena parte de este siglo, atañe al objetivo último de la biología en general y de la fisiología en particular: ¿cómo funcionan nuestros órganos y células? y más concretamente ¿cómo se regula la función de un tejido ante una situación concreta? Aunque la respuesta a esta pregunta es demasiado compleja para este contexto, una parte de ella nos sirve para iniciar la historia del principal protagonista de nuestra historia: el ion calcio o Ca2+.
Pero ¿por qué este ion ha sido objeto de estudio durante décadas? Recordemos que nuestro organismo está formado por millones de células entre las cuales debe establecerse comunicación. Los mensajeros encargados de esta comunicación son las hormonas, moléculas liberadas por ciertos tejidos, y los neurotransmisores, liberados por los nervios en la inmediación de otras células. Si seguimos con nuestra historia inicial, cuando el quimo gástrico va pasando al duodeno, las proteínas y el ácido que contiene hacen que la mucosa intestinal libere en la circulación varias hormonas que, al llegar a las células del páncreas, se unen a su receptor (una proteína incrustada en la membrana plasmática de la célula). Ahora, estos mensajeros intercelulares (primeros mensajeros) deben usar un "lenguaje" o mensajero intracelular (segundo mensajero) que sea entendido por las estructuras de la célula de las que el organismo espera obtener una repuesta, en nuestro caso la secreción de jugo pancreático. Pues bien, el ion Ca2+ es el sistema de señales intracelulares aparentemente más ubicuo, más investigado y conocido y con mayor número de implicaciones fisiológicas y patológicas entre todos los conocidos.
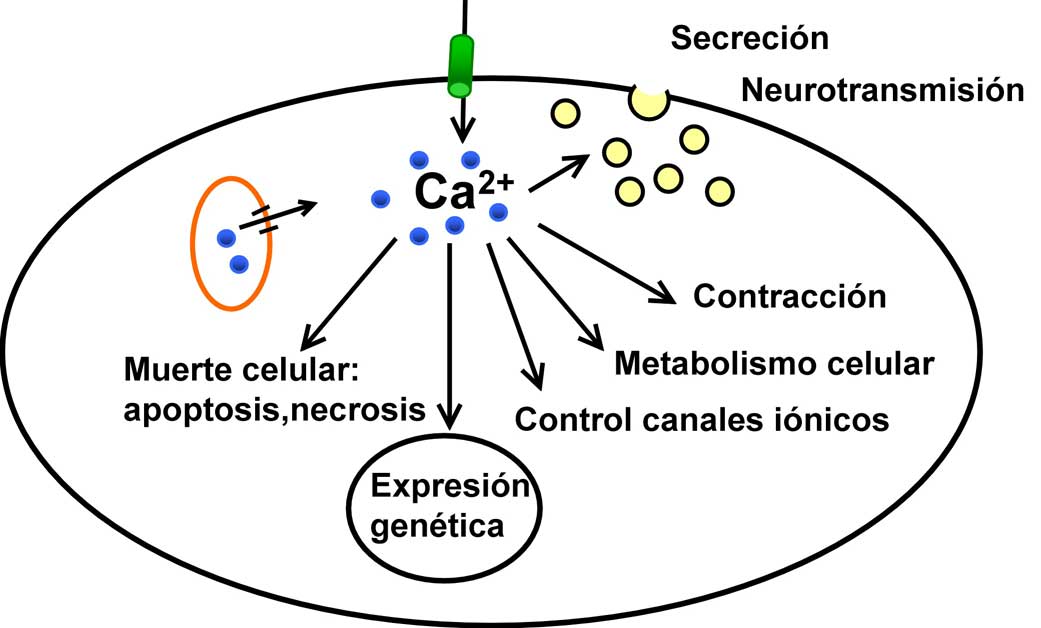
Figura 1. Algunas de las funciones celulares dependientes del ion calcio en las células de mamíferos.
La importancia del calcio en algunas funciones celulares ya había sido descubierta por Ringer a fines del siglo pasado, cuando observó que el músculo cardiaco no se contraía adecuadamente si se encontraba en una solución fisiológica preparada con agua destilada en vez de agua del grifo (Ringer, 1883). El motivo era que el Ca2+ del agua de grifo era necesaria para la contracción. Posteriormente se hizo evidente que esta misma dependencia se daba en otros tejidos: en los años sesenta se concluyó que en la secreción de adrenalina por la médula adrenal participaba el Ca2+ extracelular (Douglas & Rubin, 1961), lo que dio lugar al concepto de acoplamiento estímulo-secreción, similar al existente previamente de excitación-contracción para el músculo, según el cual la respuesta celular era mediada por el ion Ca2+. También el sistema nervioso resultó depender del calcio para la liberación de los neurotransmisores, que son las señales existentes entre dos neuronas o entre neuronas y otros tejidos (Katz, 1969). Como además numerosas hormonas aumentaban la concentración de Ca2+ en el citosol ([Ca2+]i) de sus células diana, la conclusión era obvia: el calcio es un mensajero intracelular utilizado por determinados mensajeros extracelulares, como por ejemplo la hormona CCK, liberada desde la mucosa intestinal durante la digestión. Actualmente sabemos que las señales de Ca2+ o cambios de [Ca2+]i son responsables de funciones tan distintas como la secreción, la contracción muscular, la comunicación entre neuronas, la muerte celular, etc. Pero lo que discutiremos es ¿cómo se generan y regulan estas señales de Ca2+? Estas preguntas permanecieron sin respuesta durante bastante tiempo, y hoy sólo sabemos contestarlas parcialmente.
Para esbozar una respuesta volveremos al tejido pancreático con el que iniciábamos nuestra historia. Ahora estamos en los años 50. Los Hokin, un matrimonio de investigadores norteamericanos en una estancia en Inglaterra, intentan reproducir observaciones de un científico ruso. Al incubar fragmentos de páncreas de palomas con CCK o con el neurotransmisor acetilcolina (o ACh) (otro estimulante del páncreas), la composición lipídica de las membranas de las células cambiaba rápidamente (Hokin y Hokin, 1955). Posteriormente observaron que este efecto también ocurría en cerebro y que el cambio de composición consistía en que los estimulantes descomponían a gran velocidad un tipo de lípidos de membrana llamado fosfolípidos de inositol, más exactamente el fosfatidil inositol 4,5 bifosfato (PI(4,5)P2). Aunque durante años intentaron descubrir el significado de este proceso hubo que esperar a que en 1975 Mitchell, un investigador británico, basándose en resultados previos de numerosos autores, formulase una hipótesis que relacionaba la hidrólisis de los lípidos de inositol con las señales de Ca2+: los neurotransmisores y hormonas que movilizan el Ca2+ lo hacen hidrolizando los lípidos de inositol, y un producto de esta hidrólisis es el factor que hace que el calcio intracelular aumente en la célula (Michell, 1975). Sólo en 1983 fue posible, utilizando nuevamente como modelo el páncreas exocrino, identificar el producto que iniciaba la señal de calcio, y resultó ser una pequeña molécula llamada 1,4,5 trisfosfato de inositol o IP3, como descubrió Michael Berridge en colaboración con el laboratorio de Irene Schulz, de Alemania (Streb y cols., 1983). Como podemos ver, en este campo hay contribuciones claves de numerosos investigadores, lo que quizás sea una explicación (¿o excusa?) de por qué ninguno de ellos ha recibido el premio Nobel, algo que sí han conseguido algunos de los descubridores de otros mensajeros intracelulares como el adenosin monofosfato cíclico (AMPc) o el óxido nítrico (NO) —aunque relegando a Salvador Moncada-. Pero esa sería otra historia.
El lenguaje del Ca2+
Las señales de calcio que muchos mensajeros intercelulares producen en las células pueden considerarse como un código o lenguaje que produce en los tejidos la respuesta deseada. A descifrar esto han contribuido excepcionalmente marcadores ópticos fluorescentes (quimioluminiscentes en algunos casos) que, introducidos fácilmente en las células, emiten más o menos luz en función de la [Ca2+]i. El más utilizado ha sido el fura-2, desarrollado por el estadounidense Roger Tsien a mediados de los 80, y esencial en el desarrollo de este campo.
Básicamente, los métodos de medida iniciales (isótopos radiactivos del Ca2+, electrodos de Ca2+, marcadores ópticos en poblaciones celulares enteras) nos enseñaron que un primer mensajero aumenta la [Ca2+]i de manera transitoria, con un pico o elevación inicial seguida de un descenso posterior hasta un nivel final variable según el estímulo y el tejido (véase la figura 2A). Ese aumento sería una de las señales intracelulares que conducen a la secreción, la contracción, etc. A mayor nivel de estimulación y de [Ca2+]i, mayor respuesta celular. Pero a principios de los 90 la aplicación del microscopio permitió medir la [Ca2+]i en tiempo real en células individuales (y no en suspensiones de hasta millones de células, como ocurría antes), y trajo una sorpresa: Cobbold y Cuthbertson, de la Universidad de Liverpool, observaron que al estimular hepatocitos la [Ca2+]i aumentaba de manera cíclica, formando lo que hoy llamamos oscilaciones de calcio (Woods y cols., 1986) (Figura 2B).
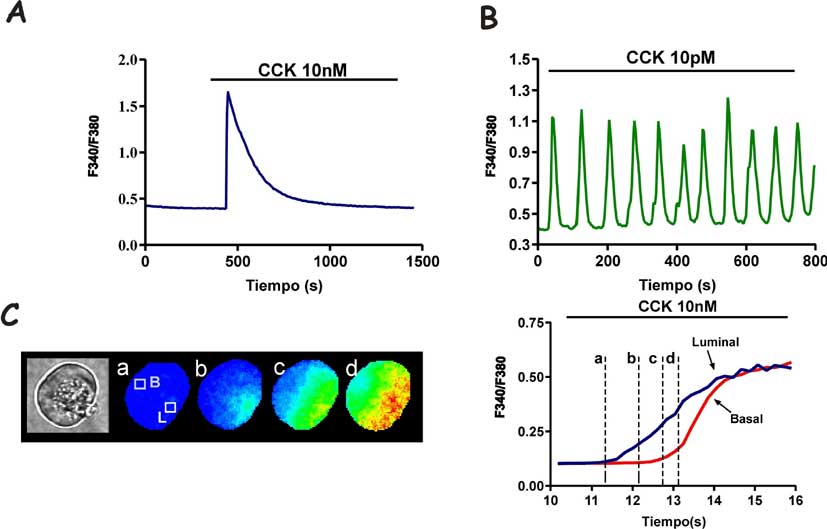
Figura 2. Algunos tipos de señales de calcio. A y B Las gráficas representan aumentos en la concentración de calcio citosólico en células acinares de páncreas cargadas con el indicador Fura-2 (la fluorescencia del Fura-2 es índice de la concentración de calcio). Puede observarse tanto una respuesta transitoria a una concentración máxima de la hormona CCK (10 nM) como oscilaciones en respuesta a concentraciones postprandiales (10 pM). C contiene una secuencia de imágenes de fluorescencia de células acinares durante la estimulación inicial con ACh. En cada imagen el color rojo representa mayor concentración de calcio, y los colores azules menor concentración. El gráfico muestra la concentración de Ca2+ en los polos secretor (luminal) y basal. El primero es la zona granulosa de la fotografía de la izquierda. Obsérvese que el polo luminal responde antes que el basal.
Este hallazgo modificó sustancialmente la visión que se tenía de las señales de calcio. Previamente, se pensaba que una vez que el calcio aumentaba en una célula, su acción se extendía por toda ella de una manera gradual y paulatina. Pero esa señal, de tipo analógico, no es demasiado eficiente si la comparamos con señales de tipo "digital". Y eso es lo que parecen ser las oscilaciones. Una oscilación tiene dos parámetros básicos, la amplitud y la frecuencia. Cuando una célula necesita activar un proceso determinado puede simplemente aumentar uno de estos parámetros (como las ondas de radio), con lo que evita un efecto indeseable del calcio, su toxicidad. Además, cambios en la frecuencia y la amplitud permiten mayor riqueza de "palabras" que un simple cambio gradual de [Ca2+]i, con lo que se pueden dirigir mensajes específicos a proteínas u orgánulos sin que se activen otros innecesariamente, ya que cada uno podría ser activado por un patrón diferente de ciclos. Recientemente se ha demostrado que incluso la expresión génica es regulada mediante estas oscilaciones (Li y cols., 1998). Más aún, un elegante estudio en células pancreáticas acinares ha demostrado por vez primera de manera directa que con cada oscilación de Ca2+ tienen lugar cambios simultáneos en la concentración de la proteína calmodulina, uno de los puntos de acción más ubicuos e importantes para el ion calcio a la hora de activar funciones celulares (Craske y cols., 1999). La implicación de este hallazgo es que las oscilaciones de Ca2+ realmente tienen una consecuencia directa e inmediata sobre los procesos bioquímicos que son la base de las funciones celulares.
Otra ventaja de las oscilaciones es que energéticamente serían menos costosas de controlar que una señal analógica, porque la célula no tendría que esforzarse continuamente en bombear el calcio fuera del citosol (como veremos más adelante), sino tan sólo durante el momento en que se produjera cada ciclo de calcio. Y por último, en una señal oscilatoria es mucho más fácil distinguir lo que es una señal (una oscilación) del ruido de fondo que en el caso de una señal basada en el valor absoluto de la [Ca2+]i.
El uso del microscopio también ha conducido a otro descubrimiento sorprendente: con frecuencia las señales de calcio se expanden por el citosol a partir de una zona concreta de la célula, como una onda u ola de Ca2+ (Gilkey y cols., 1978). Uno de los primeros tejidos en los que se observó la presencia de olas de calcio fueron las células del páncreas exocrino (Kasai & Augustine, 1990) (Figura 2C). Estas células están polarizadas, con los gránulos secretores (zimógeno) ocupando completamente el polo luminal o apical, mientras el retículo endoplasmático se expande por casi la totalidad de la zona basolateral de la célula. Cuando la ACh o la CCK estimulan estas células el primer sitio en que aumenta el [Ca2+]i es el polo apical. Incluso, y más sugerente desde el punto de vista fisiológico, para grados de estimulación considerados fisiológicos (concentraciones de CCK similares a las que hay en la sangre durante la digestión), este polo puede desarrollar oscilaciones locales que, restringidas a esa zona, no se expanden al resto de la célula (Thorn y cols., 1993).
Desde el punto de vista de la fisiología celular la aparición de señales subcelulares, restringidas a una zona de la célula, es una gran ventaja, ya que permite que solamente se active esa zona. Pensemos, por ejemplo, en las neuronas o en las células acinares. Las primeras solamente necesitan, de manera rutinaria, que el calcio aumente en los terminales sinápticos para poder liberar neurotransmisor. En el caso del páncreas, para activar la exocitosis y secreción de las enzimas digestivas es suficiente que se formen señales dentro de la zona apical, donde tiene lugar la exocitosis. Más adelante veremos cómo se organizan los elementos de la señal de Ca2+ para hacer posible esa compartimentalización de la señal de calcio.
El alfabeto del calcio
La figura 3 muestra un esquema simplificado de lo que sabemos hoy acerca de cómo las hormonas incrementan la concentración citosólica de Ca2+, que en una célula cualquiera es unas 10.000 veces menor que la concentración en el plasma y demás líquidos extracelulares. En el interior de los orgánulos intracelulares, como el retículo endoplasmático (cisternas subcelulares que, entre otras funciones, sintetizan las proteínas de una célula), la concentración de Ca2+ libre es también elevada, entre cientos y quizás miles de veces la del citosol. Por tanto, si se desea que aumente la [Ca2+]i, lo más sencillo es simplemente abrir un canal (una molécula que actúa como una puerta proteica) para que el Ca2+ confinado en esos verdaderos depósitos intracelulares y en el exterior de las células entre en el citosol a gran velocidad. Y esto es lo que hacen las células. Tomando como ejemplo las células acinares del páncreas, la unión de la CCK a su receptor de membrana hidroliza PI(4,5)P2 gracias a proteínas intermedias denominadas proteínas G. El resultado es que se genera una gran cantidad de IP3, molécula de pequeño tamaño que difunde a gran velocidad por el citosol y se une a un canal de los depósitos internos de Ca2+ denominado receptor del IP3 o IP3R. Como consecuencia, el canal se abre y permite la salida de iones calcio desde los depósitos, lo que conduce al aumento de [Ca2+]i.
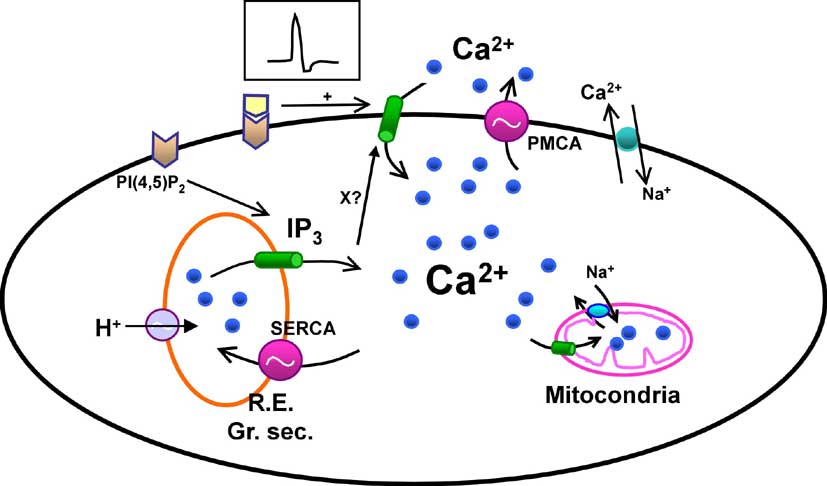
Figura 3. Principales mecanismos de control de la concentración de Ca2+ citosólico. Los mensajeros extracelulares producen señales liberando calcio desde los depósitos intracelulares mediante IP3 o abriendo canales de calcio de la membrana plasmática, bien por despolarización (caso de las neuronas) bien por interacción directa con el canal (como glutamato en algunas sinapsis). En cualquier caso, el vaciamiento de los depósitos (retículo endoplasmático, y probablemente gránulos secretores) abre, mediante un mecanismo desconocido (X?), un tipo de canales de calcio diferentes (entrada capacitativa de calcio). Para mantener controlada la concentración de calcio y evitar incrementos excesivos, las células retiran el calcio del citosol mediante bombas o intercambiadores de la membrana plasmática (PMCA, Na/Ca) o mediante bombas de los depósitos (SERCA). El rellenado de los depósitos requiere la presencia de protones (H+) en su interior. Otros orgánulos como las mitocondrias también pueden captar calcio.
Una pregunta importante es ¿cuál es la identidad del depósito de Ca2+? Todas las evidencias indican que se trata del retículo endoplasmático, aunque hace muy poco algunos estudios han señalado que probablemente en él existan subcompartimentos. Esto último es todavía un misterio, sobre todo porque los datos experimentales indican que, desde el punto de vista funcional hay más de un depósito, como si el retículo tuviese compartimentos, aunque morfológicamente esto no es así. Sencillamente, aunque ha habido algunos avances recientes (Alvarez y cols., 1999) no disponemos de la tecnología necesaria para observar el interior de los depósitos con la suficiente resolución como para contestar esta pregunta.
Además del retículo podrían tener importancia como depósitos otros dos orgánulos: los gránulos de secreción y las mitocondrias. Durante mucho tiempo los primeros han sido considerados como un punto con gran cantidad de calcio pero no movilizable por los estimulantes celulares. Sin embargo, algunos resultados muy recientes, y todavía controvertidos, indican que el IP3 puede liberar calcio desde su interior, como se ha demostrado directamente en gránulos aislados de zimógeno del páncreas (Mogami y cols., 1997). Esto coincidiría plenamente con la localización del punto de inicio de las señales en estas células. En cuanto a las mitocondrias, es ya sabido hace tiempo que pueden acumular calcio cuando la [Ca2+]i llega o supera 1 ÁM (frente al 0.1 ÁM en reposo). Pero gracias al desarrollo de la microscopía confocal (microscopía de luz de alta resolución en profundidad) y marcadores fluorescentes que se localizan exclusivamente en las mitocondrias, se ha podido detectar que realmente pueden actuar como un sistema de captación del Ca2+ citosólico de una manera continua, modulando las señales producidas por hormonas y neurotransmisores al actuar como un tampón de Ca2+.
Otro aspecto que es hoy tema de intenso estudio son los aspectos "subcelulares" de las señales de calcio. En efecto, cuando la microscopía revolucionó el estudio del Ca2+ no solamente descubrió la presencia de oscilaciones y olas de Ca2+. Como ya señalamos antes, se encontró que podían producirse señales de Ca2+restringidas a zonas pequeñas de la célula. En el músculo se han denominado sparks ("chispas") y parecen tener importancia en el desarrollo de la contracción.
Desde un punto de vista fisiológico, toda esta heterogeneidad de señales se organiza de una manera precisa y controlada en la función celular. Pensemos de nuevo en las pequeñas células acinares pancreáticas. Tienen un polo repleto de gránulos de zimógeno que han de verter hacia los conductos pancreáticos cuando la ACh y la CCK liberadas durante la digestión activen en ellas señales de Ca2+, algo que puede durar al menos decenas de minutos. Pero, para no activar innecesariamente múltiples procesos (algunos indeseables), las células circunscriben esas señales al polo apical utilizando varias estrategias. Primero, liberan el Ca2+ inicialmente desde los depósitos de esa zona, donde es más necesaria su presencia puesto que es ahí donde ocurre la exocitosis. Y eso ocurre en presencia de muy baja estimulación, como es probable que ocurra durante la fase cefálica de la digestión, cuando el olor o la visión de la comida (o incluso su mera evocación) activa las fibras de un nervio denominado vago que libera en nuestro páncreas ACh. Segundo, adoptan estrategias que tienden a restringir la señal. Recientemente hemos descrito que las células acinares tienen una altísima capacidad de unir o tamponar el Ca2+ citosólico (varios órdenes magnitud más que otras células) (Mogami y cols., 1999), lo que evita la difusión.. A esto ayuda la gran capacidad de reacumulación de calcio que tienen los depósitos (Camello y cols, 1996) y la acumulación en las mitocondrias (Tinnel y cols, 1999). Además, expulsan con gran velocidad el calcio por el polo apical, donde se inicia la señal, lo que también ayuda a evitar su difusión (Belan y cols, 1997). Estas señales de Ca2+ causan la exocitosis de los gránulos más cercanos a la membrana, y posiblemente "preparan" a otros para que luego, cuando la CCK es liberada al llegar el alimento al duodeno, se generen oscilaciones de [Ca2+]i que estimulan la secreción más intensamente. Para activar en el retículo, núcleo y otros puntos, la formación de nuevos gránulos de secreción que reponen las proteínas secretadas una parte de las oscilaciones se expande como una ola al resto de la anatomía celular.
Este aspecto de la restricción subcelular de la señal de Ca2+ es especialmente importante, ya que un exceso de calcio tiene consecuencias tóxicas en nuestras células, como la necrosis y la apoptosis, además de alterar la fisiología de algunos orgánulos intracelulares. Este aspecto es especialmente crucial en células de pequeño tamaño si pretenden ser capaces de desarrollar aumentos de calcio restringidos a un área pequeña. Sin embargo, hasta ahora hemos olvidado cómo el calcio extracelular interviene en las señales, y de hecho interviene si recordamos que su presencia es necesaria para muchas respuestas. Cuando se pudo determinar la [Ca2+]i, se observó que, aunque la señal de Ca2+ puede iniciarse sin Ca2+ extracelular, a corto o medio plazo desaparece sin él. Además, en algunos tejidos esto ocurre muy rápidamente (por ejemplo, en la médula adrenal). Esto se debe a que las hormonas, tras liberar el Ca2+ de los depósitos, activan la entrada de Ca2+ extracelular, que entra a gran velocidad por la membrana debido a que está muy concentrado en el exterior. Este calcio de origen externo sirve para dos propósitos: recargar los depósitos y mantener la señal de [Ca2+]i producida por la hormona.
En algunos tejidos la entrada de calcio extracelular es relativamente sencilla. En células excitables que funcionan desarrollando pequeñas señales eléctricas, como neuronas y muchas células musculares lisas (presentes en vasos sanguíneos, iris, uretra, intestino y otras vísceras) el Ca2+ puede entrar simplemente porque cuando estas señales se expanden por la membrana abren canales para el Ca2+, que entra en la célula para activar determinados procesos (Figura 3). Esto es patente, por ejemplo, en las sinapsis, donde el calcio necesario para la liberación del neurotransmisor entra al abrirse en la membrana plasmática canales de calcio activados por voltaje en respuesta al cambio en la polaridad eléctrica de la membrana que ocurre al llegar a ese punto una señal nerviosa (potencial de acción).
Sin embargo, en los tejidos no excitables el modo en que las células activan la entrada de calcio extracelular sigue un sistema diferente, que además está presente también en las células excitables. Estudios en los años 80 pusieron de manifiesto que la entrada se activaba cuando los depósitos intracelulares se iban vaciando. En 1986 J.W. Putney acuñó el término entrada capacitativa de calcio (ECC) para designar un modelo según el cual el grado de vaciado/llenado de los depósitos regularía la apertura/cierre de los canales de la membrana (Figura 3). Este modelo parece ser correcto en opinión de la inmensa mayoría de los especialistas del campo pero, cómo los depósitos controlan los canales de entrada es actualmente un tema de intenso debate. Básicamente existen dos teorías o grupos de teorías: los depósitos se encuentran lo suficientemente cerca de la membrana plasmática como para que los estimulantes activen la entrada de calcio mediante una interacción molecular directa, resultado del vaciamiento. La otra teoría es que al reducirse el contenido de calcio de los depósitos se genera una señal o mensajero químico que abriría los canales. La identidad de este mensajero es también objeto de polémica: NO y guanosin monofosfato cíclico (GMPc), enzimas que fosforilan proteínas en residuos tirosina, un producto de la enzima citocromo P 450, un misterioso factor de "influx" de calcio, etc., son los principales candidatos. Sin embargo, hasta el momento todo es hipótesis. Datos apoyan y contradicen ambas hipótesis, por lo que todavía no disponemos de explicación para uno de los aspectos más importantes de la fisiología del calcio, que además tiene evidentes implicaciones fisiopatológicas.
En otro aspecto, es también misterioso el canal de entrada capacitativa: mientras que los canales de Ca2+ operados por voltaje en neuronas, músculo liso y algunas glándulas endocrinas son relativamente bien conocidos, el canal capacitativo es casi absolutamente desconocido. Sólo hace unos pocos años se ha podido comenzar a medir algunas de sus características, si bien de modo muy incompleto, pues su tamaño reducido lo sitúa más allá del límite de detección de los métodos de registro actuales. La corriente de entrada a través de este canal se denomina ICRAC (por calcium release activated current), y fue descubierta por dos fisiólogos alemanes (Hoth & Penner, 1992). Sin embargo, algunas características, como la selectividad para el calcio frente a otros cationes divalentes como el Zn2+ o el Mn2+ o frente al Na+, no parecen coincidir con lo que sabíamos acerca de la entrada capacitativa. Recientemente hemos encontrado en células de páncreas que tras la activación con ACh las características de selectividad de la entrada de calcio desde el exterior, y su dependencia de ciertas señales intracelulares, van cambiando a lo largo del tiempo, en consonancia con la descripción por otros autores de la coexistencia de más de una vía de entrada capacitativa en otros tejidos (Camello y cols., 1999). Lo más interesante es que se han encontrado en mamíferos, incluyendo el ser humano, genes que codifican un tipo de canales complejos para el calcio que presentan algunas características que podrían coincidir con nuestra descripción y la de otros autores. El producto de estos genes, como en invertebrados, son una proteína llamada TRP y otra llamada TRP-l, que son candidatos a actuar como canal capacitativo, si bien nadie lo ha demostrado todavía (Montell, 1997). Es de resaltar el hecho de que algunas proteínas que interaccionan con estos canales parecen ser capaces de formar GMPc, que es uno de los candidatos a activar la entrada del calcio. Es probable que el "misterio" de la entrada capacitativa se resuelva, como ocurrió con el ciclo de los lípidos de inositol, gracias al esfuerzo de un autor o un grupo que se dedique simplemente a montar el intrincado rompecabezas que son los miles de artículos publicados sobre el tema, como también fue el caso de la doble hélice de ADN. Aunque el círculo parece cerrarse, el influjo capacitativo sigue siendo todavía una presa muy escurridiza para la industria de la investigación. Y dado que la entrada de calcio puede estar implicada en muchos procesos patológicos (hipertensión, inflamaciones como la pancreatitis, muerte celular, etc.) es de vital importancia resolver este problema.
Junto a los sistemas que permiten la entrada de calcio al citosol, ya sea desde el exterior celular o desde el interior de los depósitos, las células disponen de sistemas para retirar este ion del citosol, algo crucial dada su posible toxicidad. Uno de ellos consiste en expulsarlo hacia el líquido extracelular. Eso lo llevan a cabo dos sistemas: una bomba de la membrana plasmática denominada Ca2+ ATPasa de la membrana plasmática, y un intercambiador Na+/Ca2+ (que aprovecha la energía cedida por iones Na+ al entrar en el citosol -a favor de su gradiente electroquímico-). Ambos sistemas operan de manera continua, incluso expulsan calcio con cada oscilación de calcio (Tepikin y cols., 1992). Sin embargo, es más poderoso otro sistema que transporta, mediante la bomba denominada Ca2+ ATPasa del retículo endoplasmático, iones calcio al interior de los depósitos. Esto no sólo reduce la [Ca2+]i, sino que sirve para rellenar los depósitos, algo crucial para mantener la capacidad de respuesta celular en la mayor parte de los tejidos. Nosotros hemos encontrado que tanto la recarga de los depósitos como el transporte al medio extracelular son procesos muy intensos en el caso de las células del páncreas, sobre todo la recarga (Camello y cols., 1996), y están modulados por la [Ca2+]i, de modo que cuando supera los niveles basales su actividad aumenta de manera espectacular.
Un aspecto poco conocido del proceso de recarga de los depósitos es el papel jugado por el pH (acidez), que ha sido investigado básicamente en células salivares y pancreáticas. Ya hace algún tiempo se lanzó la hipótesis de que la recarga depende de que existan gradientes de pH en el interior de los depósitos, de modo que el calcio y los protones se intercambian (Schulz y cols., 1989) (Figura 3). Recientemente, hemos obtenido resultados que indican por primera vez en células intactas que en los depósitos de Ca2+ existen bombas de protones que crean en su interior unas condiciones de acidez necesarias para la recarga y para redistribuir el calcio entre los depósitos a partir de los puntos de entrada (Camello y cols, 2000). Esto explicaría por qué hemos encontrado, al igual que otros investigadores, una fuerte interrelación entre el pH de una célula y la [Ca2+]i, y que los gradientes subcelulares de pH sean necesarios para que las señales de calcio se desarrollen con normalidad (González y cols., 1997). También recientemente se han demostrado en este modelo por vez primera que los depósitos de calcio actúan como túneles que transportan el calcio desde la parte basal de la célula hasta depósitos situados en el polo opuesto, con lo que se conseguiría que esos depósitos se rellenasen sin que fuese necesario un aumento a lo largo de toda la célula (Mogami y cols, 1998). Sin embargo, todavía queda prácticamente todo por descubrir acerca del modo en que se regulan y organizan estos depósitos.
Como podemos deducir de todo lo anterior, para que se pueda desarrollar el amplio rango de señales de calcio descritas hasta la fecha, las células de nuestro organismo cuentan con un delicado y complejo conjunto de sistemas de transporte de calcio que modulan un auténtico lenguaje celular, rico en matices e implicaciones y todavía profundamente incomprendido en algunos aspectos. A fin de cuentas, después de casi un siglo de investigación, el mapa de señales descubierto por dos investigadores en el intestino de un perro todavía tiene fronteras donde, como los antiguos cartógrafos, tenemos que poner la inscripción "más allá hay dragones".
Referencias Bibliográficas
Alvarez, J, Montero, M & García-Sancho, J (1999). Subcellular Ca2+ dynamics. News Physiol. Sci., 14: 161-168.
Bayliss, W M & Starling, E H (1902). Mechanisms of panceratic secretions. J. Physiol., 28: 325-353
Belan, P V, Gerasimenko, O V, Tepikin, A V & Petersen, O H (1996). Localization of Ca2+ extrusion sites in pancreatic acinar cells. J. Biol. Chem., 271: 7615-7619.
Camello, C, Pariente, J A, Salido, G M & Camello, P J (1999). Sequential activation of different Ca2+ entry pathways upon cholinergic stimulation in mouse pancreatic acinar cells. J. Physiol., 516: 399-408.
Camello, P J, Gardner, J, Petersen, O H & Tepikin, A V (1996). Calcium dependence of calcium extrusion and calcium uptake in mouse pancreatic acinar cells J. Physiol., 490: 585-593.
Craske, M, Takeo, T, Gerasimenko, O, Vaillant, C, Torok, K, Petersen, O H & Tepikin, A V. (1999) Hormone-induced secretory and nuclear translocation of calmodulin: oscillations of calmodulin concentration with the nucleus as an integrator Proc. Natl. Acad. Sci. USA 96: 4426-4431.
Douglas, WW & Rubin, RP (1961). The role of calcium in the secretory response of the adrenal medulla to acetylcholine. J. Physiol., 159: 40-48.
Gilkey, J.C., Jaffe, L.F., Rigdway, E.B. & Reynolds, G.T. (1978). A free calcium wave traverses the activating egg of the medaka, Oryzias latipes. J Cell Biol., 76: 448-466.
González, A, Pariente, J A, Salido G M & Camello, P (1997). Intracellular pH and calcium signalling in rat pancreatic acinar cells. Pflügers Arch., 4343: 609-614.
Hokin, L E & Hokin-Neaverson, M R (1989). Commentary on "Hokin, LE y Hokin, M R (1955) Effects of acetylcholine on the turnover of phosphoryl units in individual phospholipids of pancreas slices and brain cortex slices. Biochim. Biophys. Acta 18: 102-110". Biochim. Biophys. Acta, 1000: 465-469.
Hoth, M & Penner, R (1992) Depletion of intracellular calcium stores activates a calcium current in mast cells. Nature, 355: 353-356.
Kasai, H & Augustine, G J (1990). Cytosolic Ca2+ gradients triggering unidirectional fluid secretion from exocrine pancreas. Nature, 348: 735-738.
Katz, B (1969). The release of neural transmitter substances, 60p (Springfield, Thomas).
Li, W, Llopis, J, Whitney, M, Zlokarnik, G & Tsien, R Y (1998). Cell-permeant caged InsP3 ester shows that Ca2+ spike frequency can optimize gene expression. Nature, 392: 936-41.
Michell, R H (1975). Inositol phospholipids and cell surface receptor function. Biochim. Biophys. Acta, 415: 81-101.
Mogami, H, Nakano, K, Tepikin, A V & Petersen, O H (1997). Ca2+ flow via tunnels in polarized cells: recharging of apical Ca2+ stores by focal Ca2+ entry through basal membrane patch. Cell, 88: 49-55.
Montell, C (1997). New light on TRP and TRP-l. Molecular Pharmacology, 52: 755-763.
Ringer, S. (1883). A further contribution regarding the influence of the different constituents of the blood on the contraction of the heart. J. Physiol., 4: 29-42.
Schulz, I, Thévenod, F & Dehlinger-Kremer, M (1989). Modulation of intracellular free calcium concentration by Ip3-sensitive and Ip3-insensitive nonmitochondrial calcium pools. Cell Calcium, 10: 325-336.
Streb, H, Irvine, R F, Berridge, M J & Schulz, I (1983). Release of Ca2+ from a non-mitochondrial intracellular store of pancreatic acinar cells by inositol 1,4,5-trisphosphate. Nature, 306: 67-69.
Tepikin, A V, Voronina, S G, Gallacher, D V & Petersen, O H (1992). Pulsatile Ca2+ extrusion from single pancreatic acinar cells during receptor-activated cytosolic Ca2+ spiking. J. Biol. Chem., 267: 14073-14076.
Thorn, P, Lawrie, A M, Smith, P M, Gallacher, D V & Petersen, O H (1993). Local and global cytosolic calcium oscillations in exocrine cells evoked by agonists and inositol trisphosphate. Cell, 74: 661-668.
Tinnel, H, Cancela, J M, Mogami, H, Gerasimenko, J V, gerasimenko, O V, Tepikin, A V y Petersen, O H (1999) Active mitochondria surrounding the pancreatic acinar granule region prevent spreading of inositol trisphosphate-evoked local cytosolic Ca2+ signals. EMBO J. 18: 4999-5008.
Woods, N M, Cuthbertson, K S & Cobbold, P H (1986). Repetitive transient rises in cytoplasmic free calcium in hormone-stimulated hepatocytes. Nature, 319: 600-2.